Reglas de Asignación de GS1
GTIN para el sector salud
Versión 10.0, ratificada, junio de 2020
1. Introducción
El número de artículo comercial global (GTIN® por sus siglas en inglés) proporciona un estándar global al identificar cualquier artículo comercial sobre el que sea necesario recuperar información predefinida y que pueda tener un precio, pedido o facturarse en cualquier punto de la cadena de suministro. Las reglas de asignación GTIN en el sector salud están diseñadas para ayudar a la industria a tomar decisiones consistentes sobre cómo administrar la identificación única de los artículos comerciales. Estas reglas se han desarrollado de acuerdo con el Proceso de Gestión de Estándares Globales GS1 (GSMP) y se consideran parte del sistema de estándares GS1. Los costos generales se minimizan mientras que la eficiencia y la seguridad del paciente mejoran cuando todos los socios en la cadena de suministro se adhieren a las Reglas de asignación de GTIN en el sector salud. La identificación única de los artículos comerciales es fundamental para mantener la eficiencia operativa en la que los socios comerciales confían para intercambiar información sobre productos de manera coherente, así como para garantizar el buen funcionamiento de las cadenas de suministro mundiales. Además, la identificación única de los artículos comerciales es crucial cuando se cumplen diversas normativas en todo el mundo. Finalmente, la comunicación de cambios de identificación únicos entre socios comerciales es esencial para garantizar que el producto correcto esté disponible cuando sea necesario.
![]() Nota: El término “producto” tal como se utiliza en las reglas de asignación de atención médica GS1 se refiere a los artículos comerciales a los que se asignan GTIN.
Nota: El término “producto” tal como se utiliza en las reglas de asignación de atención médica GS1 se refiere a los artículos comerciales a los que se asignan GTIN.
- 1.1 Propósito y descargo de responsabilidad reglamentario
Este documento tiene como objetivo proporcionar un marco globalmente armonizado para la implementación de los estándares GS1 con el fin de mejorar la eficiencia de la cadena de suministro y garantizar la seguridad del paciente.
![]() Importante: Las Reglas de asignación de GTIN de atención médica representan un requisito mínimo. Tenga en cuenta que puede haber regulaciones en su área de mercado que sean más estrictas y DEBEN cumplirse. Consulte el Mapa interactivo de políticas públicas de atención médica para obtener más información.
Importante: Las Reglas de asignación de GTIN de atención médica representan un requisito mínimo. Tenga en cuenta que puede haber regulaciones en su área de mercado que sean más estrictas y DEBEN cumplirse. Consulte el Mapa interactivo de políticas públicas de atención médica para obtener más información.
- 1.2 Alcance
Los estándares GS1 ayudan a mejorar las operaciones de la cadena de suministro, la eficiencia del proceso y cumplir con los requisitos reglamentarios para mejorar la seguridad del paciente. Este documento proporciona reglas claras para la asignación del Número de artículo comercial global (GTIN) a productos sanitarios regulados.
Las reglas descritas en este documento están destinadas al sector sanitario regulado. Algunas de las reglas incluidas no son aplicables a otros sectores y no están incluidas en el Estándar de Gestión GTIN. Se ha hecho todo lo posible para armonizar las reglas que aparecen en ambos documentos.
![]() Nota: Términos adicionales se encuentran en la sección 5 de este documento y en el glosario en línea en el sitio web GS1 y en las Especificaciones Generales GS1
Nota: Términos adicionales se encuentran en la sección 5 de este documento y en el glosario en línea en el sitio web GS1 y en las Especificaciones Generales GS1
![]() Nota: Consulte el sitio web de GS1 Healthcare para obtener información general.
Nota: Consulte el sitio web de GS1 Healthcare para obtener información general.
- 1.3 Principios rectores
El propietario de la marca debe tener en cuenta los siguientes principios rectores al desarrollar una estrategia de asignación de GTIN para un nuevo artículo comercial y al introducir cambios en un artículo comercial existente.
■ Producto contenido en el paquete: ¿Se espera que una parte interesada (por ejemplo, proveedores de atención, consumidores, pacientes, autoridades reguladoras y / o socios comerciales) distinga el producto modificado o nuevo de los productos anteriores / actuales?
■ Etiqueta / paquete: ¿Existe un requisito regulatorio o de responsabilidad para divulgar un cambio al consumidor y / o socio comercial?
■ Etiqueta / paquete: ¿Hay un cambio sustancial que afecte la cadena de suministro (por ejemplo, ¿cómo se envía, almacena, recibe o maneja el artículo comercial en el entorno clínico)?
![]() Nota: Al menos uno de los principios rectores debe aplicarse para que se requiera un cambio de GTIN.
Nota: Al menos uno de los principios rectores debe aplicarse para que se requiera un cambio de GTIN.
Se requiere un GTIN separado y único cada vez que dos productos son diferentes en cualquier forma que sea relevante para el proceso comercial, el uso previsto o el punto de atención.
- 1.4 Definición de un nuevo producto en comparación con un cambio de producto
Al tomar decisiones sobre la identificación del producto, es importante comprender las diferencias entre un NUEVO producto y los CAMBIOS en un producto existente.
Los nuevos productos son aquellos que actualmente no existen en la oferta de productos del propietario de una marca y son nuevos en el mercado. Un nuevo producto debe considerarse una “adición” a una oferta de producto existente. Los estándares GS1 y las Reglas de asignación de GTIN en el sector salud requieren que si un producto es nuevo, siempre se le debe asignar un nuevo GTIN para distinguir con precisión el nuevo producto de aquellos actualmente disponibles en el mercado o productos existentes previamente que han sido descontinuados.
Los cambios en los productos existentes se consideran “productos de reemplazo” según lo determine el propietario de la marca. Las Reglas de asignación de GTIN en el sector salud definen que se requiere un nuevo GTIN cuando un cambio a ciertos atributos de un producto existente cambia de manera tal que se requiere un nuevo GTIN.
■ Nuevo producto: un “nuevo producto” se define como un producto que actualmente no existe o que no ha estado disponible para la venta y es una adición a la cartera del propietario de la marca / es nuevo en el mercado.
■ Cambio de producto: un producto existente, actualmente en la cartera del propietario de la marca y disponible en el mercado cuyos atributos han cambiado.
- 1.5 GTIN no reutilizable
Un GTIN asignado NO PODRÁ reasignado a otro artículo comercial. Las compañías de atención médica deben asegurarse de que los GTIN asignados a artículos comerciales de atención médica regulados NO DEBEN reutilizarse.
Excepción: los artículos comerciales de atención médica regulados que se retiraron del mercado y se reintroducen pueden usar el GTIN original si se reintroducen sin modificaciones o cambios que requieran un nuevo GTIN según lo especificado por las Reglas de asignación de GTIN en el sector salud o el Estándar de administración de GTIN.
Como ejemplo: el “Producto A”, un antibiótico inyectable de primera generación fue retirado del mercado por su fabricante debido a la disminución de las ventas. Después de una ausencia de 10 años en el mercado, el fabricante reintrodujo el “Producto A”, en su forma y configuración de paquete originales, para tratar infecciones resistentes a los antibióticos más nuevos. En este ejemplo, se puede usar el GTIN original.
![]() Nota: los GTIN asignados a productos sanitarios regulados siempre se han regido por una política de no reutilización. Fuera de la atención médica regulada, la regla general de no reutilización de GTIN entró en vigencia el 1 de enero de 2019 en respuesta a la demanda comercial digital. Los GTIN descontinuados y retirados del mercado antes del 1 de enero de 2019 pueden considerarse para su reutilización una última vez (*). Sin embargo, se recomienda encarecidamente a las empresas que sigan la regla de no reutilización para todos los GTIN para evitar riesgos de datos en conflicto.
Nota: los GTIN asignados a productos sanitarios regulados siempre se han regido por una política de no reutilización. Fuera de la atención médica regulada, la regla general de no reutilización de GTIN entró en vigencia el 1 de enero de 2019 en respuesta a la demanda comercial digital. Los GTIN descontinuados y retirados del mercado antes del 1 de enero de 2019 pueden considerarse para su reutilización una última vez (*). Sin embargo, se recomienda encarecidamente a las empresas que sigan la regla de no reutilización para todos los GTIN para evitar riesgos de datos en conflicto.
(*) Si se retiró un GTIN antes del 1 de enero de 2019, se deben cumplir las reglas previamente aplicables.
Para obtener más información, consulte las especificaciones generales de GS1, sección de no reutilización de GTIN.
2. Reglas de asignación GTIN
Aunque las regulaciones son extremadamente importantes en esta área, la mayoría de los productos de salud no regulados siguen reglas de asignación ampliamente similares a las del entorno minorista general (consulte el Estándar de administración de GTIN). Este documento incluye las reglas de asignación necesarias en el sector sanitario regulado que no se encuentran en el entorno minorista general.
Las reglas de asignación en esta sección se aplican a cualquier tipo de artículo de atención médica.
A continuación, se detallan las reglas que definen cuándo se DEBERÁ asignar un GTIN (Producto nuevo), un Producto modificado (reemplazo) o un Producto equivalente para cumplir con las Reglas de asignación de GTIN en el sector salud.
![]() Nota: Equivalente – un producto que puede ser sustituido por el artículo comercial existente en función de la equivalencia funcional definida por el proveedor al artículo comercial en un mercado objetivo específico.
Nota: Equivalente – un producto que puede ser sustituido por el artículo comercial existente en función de la equivalencia funcional definida por el proveedor al artículo comercial en un mercado objetivo específico.
■ Por ejemplo, cuando el contenido regulatorio de la etiqueta de un producto difiere de una manera que afecta la Licencia o el Registro en un mercado particular y limita los canales de distribución, requiere que el producto se identifique de manera única para los propósitos de la cadena de suministro y el control regulatorio usando un control único y separado GTIN.
■ Diferentes mercados pueden no imponer el mismo nivel de restricción (por ejemplo, Licencia o Registro), lo que significa que ambas versiones del producto, que son funcionalmente equivalentes, pueden ser referenciadas como tales en mercados donde la restricción no se impone.
Las Reglas de asignación GTIN en el sector salud están diseñadas para ayudar a la industria de la salud a tomar decisiones consistentes sobre la identificación única de artículos comerciales. Este estándar ha sido desarrollado de acuerdo con el Proceso de Gestión de Estándares Globales GS1 (GSMP) y se considera parte del sistema de estándares GS1.
Recuerde que todas las Reglas de asignación de GTIN en el sector salud y los tres principios rectores deben tenerse en cuenta al tomar la decisión final de cambiar un GTIN.
2.1. Introducción nuevo producto
Un “nuevo producto” se define como un producto que no existe actualmente o que no ha estado disponible para la venta y es una adición a la cartera del propietario de la marca / es nuevo en el mercado.
Cualquier producto nuevo requiere la asignación de un nuevo GTIN.
Principios rectores relevantes:
|
Nombre de regla GTIN |
¿Se espera que un proveedor de atención, consumidor y / o socio comercial distinga el nuevo producto de los productos anteriores / actuales? |
¿Existe un requisito de divulgación de responsabilidad / regulación para el consumidor y / o socio comercial? |
¿Hay un impacto sustancial en la cadena de suministro (por ejemplo, cómo se envía, almacena, recibe o maneja el producto en el entorno clínico)? |
|
Introducción producto nuevo |
SI |
SI |
SI |
2.1.1 Idiomas diferentes
Esta regla proporciona orientación sobre la asignación de GTIN para intercambiar artículos con respecto a la adición y eliminación de idiomas en función del mercado objetivo en el que se venderá el producto. Esto cubre el idioma impreso en el paquete en sí, así como manuales o inserciones que se consideran parte del artículo comercial.
Cualquier cambio en el idioma que afecte dónde se puede vender un producto o cómo los socios comerciales y los usuarios finales interactúan con él, requiere la asignación de un nuevo GTIN.
Niveles de jerarquía de asignación de GTIN:
■ El GTIN se asigna en el nivel de jerarquía en el que aparece el idioma (es decir, el nivel de empaque que contiene el idioma específico).
■ Se asigna un GTIN único en cada nivel jerárquico superior.
Ejemplos de escenarios comerciales que requieren un nuevo GTIN:
■ Productos de un solo idioma con un mercado / país objetivo diferente.
Dos productos idénticos: uno dirigido a un país de habla inglesa, el otro para un país de habla hispana. Como los dos artículos existen en paralelo y no pueden ser sustituidos (debido a la aceptación del mercado y las leyes de etiquetado locales), una nueva versión de idioma que se venderá en un mercado / país objetivo requiere un GTIN separado y diferente del otro que se vende en un mercado objetivo diferente / país.
Figura 2‑1 Producto Nuevo – GTIN nuevo
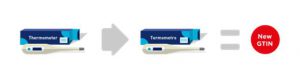
■ Cuando se elimina un idioma de un paquete multilingüe, se DEBERÁ asignar un nuevo GTIN.
Figura 2‑2 Eliminación de un idioma del paquete – GTIN nuevo

Manuales y folletos
Si se incluye un manual o folleto en el paquete del producto, se considera parte del artículo comercial identificado con un GTIN. Por lo tanto, se aplican las reglas de idioma anteriores.
En los casos en que se incluye más de un folleto en el paquete del producto, se aplican las reglas anteriores sobre eliminación y adición de idiomas.
Sobre etiquetado para un mercado objetivo específico
Cuando se coloca una etiqueta en el producto o paquete que oculta la información anterior, en parte o en su totalidad (es decir, ya no es totalmente visible) sin reproducir la información oculta en la etiqueta como se representaba originalmente, se asignará un nuevo GTIN.
![]() Nota: Cuando se agrega un etiquetado adicional que no oculta la información anterior, no se necesita un nuevo GTIN.
Nota: Cuando se agrega un etiquetado adicional que no oculta la información anterior, no se necesita un nuevo GTIN.
Ejemplo de modificación de obras de arte menores donde no se necesita un nuevo GTIN:
Las obras de arte menores u otras modificaciones menores en el empaque, que no son relevantes para los socios comerciales porque no afectan la información sobre el intercambio de productos, no requieren la asignación de diferentes GTIN.
Figura 2‑3 Actualizaciones menores al empaque – el mismo GTIN

Lenguaje adicional en el empaque vendido en varios mercados
A diferencia del empaque de un solo idioma, muchos productos están empacados para múltiples países y mercados. Cuando se agrega un idioma adicional a un artículo comercial con un idioma existente, el GTIN permanece igual.
Figura 2‑4 Adición de un idioma a un paquete existente – mismo GTIN

Información Adicional:
■ Considere las regulaciones aplicables del mercado objetivo relacionadas con los requisitos de idioma en los que se venderá el producto.
■ Algunos mercados objetivo requieren más de un idioma, consulte las regulaciones locales
2.1.2 Asignación de GTINs dentro de una jerarquía de artículos comerciales
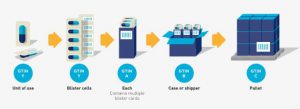
Esta regla explica la asignación de GTIN a todos los niveles de una jerarquía de artículos comerciales (por ejemplo, unidad de uso / unidad individual, cada uno, paquete interno, caja, paleta, etc.). A un nivel de jerarquía de artículos comerciales se le asigna un GTIN cuando es necesario recuperar información predefinida y puede tener un precio, un pedido o una factura en cualquier punto de la cadena de suministro. En algunos casos, esto también puede denominarse jerarquía de empaquetado. El propietario de la marca determina los niveles de jerarquía a los que se asigna un GTIN.
La información sobre el marcado (por ejemplo, el uso de códigos de barras) para los artículos comerciales regulados de atención médica se cubre en la sección titulada Embalaje secundario de atención médica (artículos comerciales regulados de consumo minorista de atención médica) de las Especificaciones Generales GS1. Para obtener información adicional sobre la implementación, consulte la Guía de implementación de GS1 AIDC Healthcare.
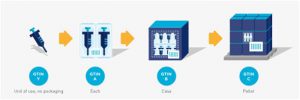
Unidad de uso / Unidad individual
Los productos en la mayoría de los sectores se identifican en múltiples niveles jerárquicos de empaque (ver sección 2.8). El nivel jerárquico más bajo de artículos comerciales dentro del Sistema GS1 se conoce tradicionalmente como el nivel “cada”. El artículo comercial de “cada” nivel puede contener más de una unidad de uso. En este caso, puede ser necesario identificar niveles por debajo de “cada uno” hasta la única unidad o unidad de uso. A los efectos de esta regla, “unidad única” y “unidad de uso” son sinónimos.
![]() Nota: Dependiendo del mercado objetivo, podrían aplicarse requisitos de etiquetado para el nivel inferior a cada unidad individual.
Nota: Dependiendo del mercado objetivo, podrían aplicarse requisitos de etiquetado para el nivel inferior a cada unidad individual.
Niveles de jerarquía de asignación de GTIN:
■ Se asigna un GTIN en el nivel “cada”.
■ A los niveles más altos de empaque se les asigna un GTIN único y separado en cada nivel si estos niveles se consideran artículos comerciales. Vea la sección 2.8 para más información.
■ Los niveles por debajo de “cada”, hasta la unidad de uso / unidad individual deben tener un GTIN asignado. Sin embargo, puede o no estar marcado en esos niveles.
Ejemplos de escenarios comerciales que requieren un GTIN:
Dispositivos médicos
Se recomienda para los dispositivos médicos que solo haya un solo nivel de un producto por debajo del nivel de paquete más bajo para garantizar la precisión en la cadena de suministro y garantizar la trazabilidad.
![]() Nota: Sin embargo, se reconoce que puede existir una pequeña cantidad de excepciones donde existe más de un nivel.
Nota: Sin embargo, se reconoce que puede existir una pequeña cantidad de excepciones donde existe más de un nivel.
En el siguiente ejemplo, “cada” contiene un recuento de dos (es decir, con fines ilustrativos, el recuento podría significar dos dispositivos). En este caso, hay dos unidades individuales, o “unidades de uso”, por “cada”.
Figura 2‑5 Jerarquía con una unidad de uso
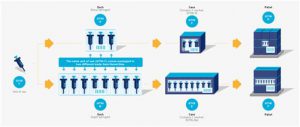
En el ejemplo, un dispositivo de unidad de uso está disponible en dos configuraciones, un artículo vendible (es decir, “cada uno”) con tres jeringas y un artículo vendible con ocho jeringas. En ambos casos, la unidad de uso tendría el mismo GTIN, mientras que al resto de la jerarquía de empaquetado se le asignan GTIN diferentes y únicos.
Figura 2‑6 En este ejemplo, la unidad de uso (GTIN-Y) está empaquetada en dos jerarquías de artículos comerciales diferentes, pero puede o no estar marcada
Puntos de electrodos:
Los puntos de electrodo se usan en electrocardiogramas. La unidad comercializada / empaquetada más baja es una “Bolsa” que contiene 3, 5 o 10 “tiras” donde cada “tira” contiene 5 o 10 puntos individuales. La bolsa es la unidad comercializada más baja (nivel más bajo registrado en la cadena de suministro) y a menudo se empacan en niveles más altos de 5 o 10 bolsas a un nivel de empaquetado intermedio. Puede haber 4 o 6 de estos en un caso de expedidor (es decir, unidad de logística). Las tiras y los puntos no se empaquetan individualmente.
En este ejemplo, los puntos son la unidad de uso. Es posible que no se utilice un número establecido en cada procedimiento, sin embargo, tienen ubicaciones establecidas en un paciente. La razón de la variación es que a veces los puntos se caen y se usa uno nuevo. Es posible que se eliminen los puntos de una sola tira y se usen en varios pacientes, se pueden retirar del área de la tienda o del carrito y se puede volver a almacenar el no utilizado.
En los ejemplos de las figuras 2-6 y 2-7, “cada”, “caso” y “paleta” son artículos comerciales y se identifican con GTIN únicos y separados (A, B y C, respectivamente). El “nivel debajo de cada uno” contiene una sola unidad (es decir, unidad de uso) y debe tener un GTIN asignado (GTIN Y). Sin embargo, puede estar marcado o no (es decir, código de barras / HRI o no HRI) en la unidad individual.
Figura 2‑7 Jerarquía con una unidad de uso (ejemplo de tira de prueba de glucosa)

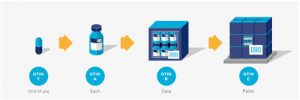
Productos farmacéuticos
Figura 2‑8 Jerarquía con una sola unidad
Píldoras / tabletas / cápsulas / cápsulas individuales sin empacar y aquellas empaquetadas en blister
No se espera que los GTIN asignados a píldoras, tabletas, cápsulas o cápsulas desempaquetadas individuales se marquen utilizando la tecnología AIDC (por ejemplo, códigos de barras). Si “cada” contiene varias unidades del producto que se pueden separar fácilmente en unidades individuales de uso, como en un paquete de blíster perforado, las unidades individuales deben identificarse, pero pueden o no marcarse.
Figura 2‑9 En este ejemplo, la tarjeta de la ampolla se identifica y se marca con un solo GTIN. La unidad de uso se identifica con un GTIN pero no está marcado. La marca queda a criterio del propietario de la marca.
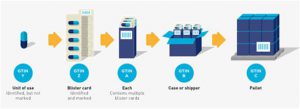
Figura 2‑10 En este ejemplo, cada celda de la ampolla se identifica y se marca. La tarjeta de la ampolla no está identificada o marcada. La marca queda a criterio del propietario de la marca.
Información Adicional:
Soluciones sin envasar / líquidos / cremas / geles / polvos / aerosoles
No se espera que se asigne un GTIN a líquidos, cremas, geles, polvos y aerosoles sin envasar, por ejemplo, a menos que lo exija la regulación o lo acordado en una relación de socio comercial. Los GTIN asignados a estos elementos no empaquetados no se marcan con la tecnología AIDC (por ejemplo, códigos de barras).
![]() Nota: Los niveles más altos de embalaje, como una caja o paleta, se pueden identificar con un GTIN cuando se identifica un artículo comercial. Si los artículos comerciales se agruparan con fines de transporte y / o almacenamiento, la agrupación se clasificaría como una unidad logística y se identificaría con un Código de contenedor de envío en serie (SSCC). A una caja, paleta u otra agrupación de artículos comerciales se le puede asignar un GTIN para la identificación del producto y un SSCC para fines logísticos. Para obtener más información sobre SSCC, consulte las Especificaciones generales de GS1.
Nota: Los niveles más altos de embalaje, como una caja o paleta, se pueden identificar con un GTIN cuando se identifica un artículo comercial. Si los artículos comerciales se agruparan con fines de transporte y / o almacenamiento, la agrupación se clasificaría como una unidad logística y se identificaría con un Código de contenedor de envío en serie (SSCC). A una caja, paleta u otra agrupación de artículos comerciales se le puede asignar un GTIN para la identificación del producto y un SSCC para fines logísticos. Para obtener más información sobre SSCC, consulte las Especificaciones generales de GS1.
Diferenciación entre paquete primario y paquetes secundarios en una relación uno a uno (1:1)
Algunos procesos de atención médica requieren la capacidad de diferenciar claramente entre un artículo comercial de atención médica en su empaque primario y secundario, incluso si comparten una relación “uno a uno” (1:1). Un ejemplo podría ser un tubo de crema en una caja, un vial en una caja o una jeringa en una caja de cartón. En esta situación, el paquete primario del artículo comercial y el paquete secundario pueden tener diferentes GTIN asignados cuando así lo requiera la regulación o según lo acordado dentro de una relación de socio comercial en ausencia de requisitos regulatorios. La asignación de GTIN y el marcado de GTIN se realizan a discreción del propietario de la marca.
Consulte las Especificaciones generales de GS1 para obtener más información sobre agrupaciones de artículos comerciales.
Para obtener más información, consulte la sección Embalaje primario de atención médica (artículos comerciales no minoristas) de las Especificaciones generales de GS1.
2.1.3 Dispositivos de un solo uso no estériles / dispositivos múltiples nunca se venden por separado
Los dispositivos médicos de un solo uso, no estériles, empacados más de uno en un paquete y los dispositivos múltiples que no se venden comúnmente por separado (por ejemplo, la cantidad de bastoncillos de algodón, individualmente empaquetados y contenidos en una sola bolsa) pueden requerir que se asigne un GTIN único.
Niveles de jerarquía de asignación de GTIN:
■ Se asigna un GTIN en el nivel “cada uno”.
■ A los niveles más altos de empaque se les asigna un GTIN único y separado en cada nivel si estos niveles se consideran artículos comerciales. Vea la sección 2.8 para más información.
■ El nivel por debajo de cada uno, hasta la unidad individual (es decir, la unidad de uso) puede tener un GTIN asignado. Sin embargo, puede o no estar marcado en esos niveles.
Ejemplos de escenarios comerciales que requieren un nuevo GTIN:
Ejemplos de dispositivos múltiples que no se venden comúnmente por separado y que pueden requerir la asignación de un GTIN, como tornillos / pernos de gran cantidad, guantes / batas, hisopos, cinta adhesiva, cantidad de hisopos de algodón, individualmente sin embalaje y contenidos en una sola bolsa y ejemplos de use dispositivos no estériles que incluyen gasa, hisopo, tejido, etc.
Información Adicional:
Para obtener información sobre dispositivos no estériles de usos múltiples, consulte la sección 2.1.4.
2.1.4 Dispositivos de un solo uso no estériles / dispositivos múltiples nunca se venden por separado
Se debe asignar un GTIN a una sola unidad de un dispositivo no estéril de usos múltiples.
Niveles de jerarquía de asignación de GTIN:
■ El GTIN se asigna en la unidad individual.
■ Se asigna un GTIN por separado en cada nivel de empaque de la jerarquía que puede tener un precio, un pedido o una factura.
Ejemplo de escenario empresarial:
Un manguito de presión arterial no desechable es un ejemplo de un dispositivo no estéril de usos múltiples.
Información Adicional:
Los GTIN, asignados al nivel debajo de cada uno (por ejemplo, una sola unidad o unidad de uso), pueden marcarse utilizando la tecnología AIDC (por ejemplo, códigos de barras). Dependiendo del tipo de dispositivo, puede haber requisitos reglamentarios para el marcado directo de piezas
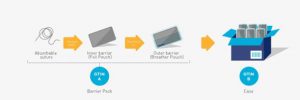
2.1.5 Paquetes de barrera: sellado interior a exterior (proceso SITO)
La regla general es que cada nivel de empaque requiere un GTIN separado y único. Sin embargo, para ciertos procesos de fabricación, como la formación de un paquete de doble barrera estéril, donde una barrera no se puede crear como estéril sin la otra es una situación de fabricación única y, por lo tanto, se considera una parte integral de un solo nivel de paquete cuando se completa. Los niveles de barrera constituyentes independientes y separados después del proceso de fabricación no se consideran niveles de empaquetado distintos de la jerarquía de artículos comerciales para la asignación de GTIN, siempre que el nivel superior (por ejemplo, barrera exterior) solo contenga una unidad del nivel inferior (por ejemplo, barrera interna) y la barrera interna requiere que la barrera externa forme la unidad estéril dentro del proceso de fabricación. Ver Figura 2 11.
El siguiente ejemplo muestra un producto típico donde la esterilización requiere dos niveles de empaque (es decir, empaque de doble barrera). Cuando se utiliza la sutura, ciertos niveles de empaque solo se pueden abrir en un ambiente estéril. Sin embargo, la bolsa de aluminio en sí o la sutura no requieren un GTIN por separado. Tenga en cuenta que en este ejemplo, la bolsa de respiración contiene una bolsa de aluminio, que a su vez contiene una sutura; esta es una condición previa para asignar el mismo GTIN a este artículo comercial. Cuando la bolsa de aluminio contiene más de una unidad de uso, esto invoca la regla de la unidad de uso según la sección 2.1.2 para la asignación de un GTIN.
Figura 2‑11 Paquetes de barrera (embalaje estéril)
2.2. Formulación o funcionalidad declarada
La “funcionalidad” se define como el uso particular o conjunto de usos para los que se diseña algo. La “formulación” se define como una lista de los ingredientes o componentes utilizados para crear un artículo comercial.
Un cambio en la formulación o funcionalidad que afecta la información declarada legalmente requerida en el empaque de un producto solo requiere la asignación de un nuevo GTIN si el propietario de la marca espera que el cliente o socio de la cadena de suministro distinga la diferencia entre los productos antes y después del cambio. Ambas condiciones deben cumplirse y requieren la asignación de un nuevo GTIN.
Ejemplos de escenarios comerciales que requieren un nuevo GTIN
■ Cambiar a un ingrediente activo en un producto
■ Cambiar a un excipiente en un producto.
■ Cambiar a un material diferente para el embalaje primario.
■ La adición de un nuevo ensayo al equipo de prueba de laboratorio.
Principios rectores relevantes:
|
Nombre de regla GTIN |
¿Se espera que un proveedor de atención, consumidor y / o socio comercial distinga el nuevo producto de los productos anteriores / actuales? |
¿Existe un requisito de divulgación de responsabilidad / regulación para el consumidor y / o socio comercial? |
¿Hay un impacto sustancial en la cadena de suministro (por ejemplo, cómo se envía, almacena, recibe o maneja el producto en el entorno clínico)? |
|
Formulación o funcionalidad declarada |
SI |
SI |
SI |
2.2.1 Producto específico para pacientes
En el caso de que un producto se prepare específicamente para un paciente individual (por ejemplo, en una farmacia del hospital o por un fabricante de implantes), la parte que prepara o fabrica el producto es responsable de asignar el GTIN. Se debe identificar un producto específico del paciente para que se le atribuya de manera única al paciente individual y / o una instancia de producción específica.
Niveles de jerarquía de asignación de GTIN:
■ Se asigna un GTIN al producto base definido por propiedades clave como ingredientes, fórmula básica, indicaciones, diseño fundamental, etc. El GTIN identifica el producto específico del paciente para el producto base y un lote / lote y / o número de serie. Se asignará un nuevo GTIN cuando cambie cualquiera de las propiedades clave del producto base.
![]() Nota: A discreción del propietario de la marca, se puede asignar un nuevo GTIN a cada producto específico del paciente. Este método está limitado por la cantidad de GTIN disponibles para el fabricante o dispensador.
Nota: A discreción del propietario de la marca, se puede asignar un nuevo GTIN a cada producto específico del paciente. Este método está limitado por la cantidad de GTIN disponibles para el fabricante o dispensador.
Ejemplo de escenario empresarial:
La farmacia de un hospital prepara un producto específico diseñado para un paciente específico. En algunos casos, esto se refiere a una “medicina personalizada”.
Consulte la sección 2.2.2 para ver ejemplos de dispositivos médicos configurables.
2.2.2 Dispositivos médicos configurables
Un dispositivo médico configurable es un producto que consta de múltiples componentes, algunos de los cuales pueden ser seleccionados por el cliente en función de una lista proporcionada por el fabricante. Las posibles configuraciones están determinadas por el diseño del producto. En todos los casos, los dispositivos médicos configurables se consideran y están destinados a ser utilizados como un solo artículo comercial.
Niveles de jerarquía de asignación de GTIN:
■ Se asigna un GTIN a todo el dispositivo médico configurable.
□ OPCIÓN 1: Asigne un GTIN a cada instancia final del dispositivo. Por ejemplo, cada configuración personalizada tiene su propio GTIN.
□ OPCIÓN 2: Asigne un GTIN al componente base (es decir, la parte del dispositivo a la que se agregan los componentes opcionales). Por ejemplo, el bastidor / chasis de la cama base, el soporte del monitor base, etc. Luego, al finalizar, asigne un número de serie a la instancia personalizada final del dispositivo. Los cambios, modificaciones o mantenimiento del dispositivo podrían ser rastreados a través de cambios, modificaciones o registros de mantenimiento a nivel de número de serie.
■ Un cambio en la forma, ajuste o función de un componente obligatorio que afecte el uso previsto, requiere un cambio en el número de serie GTIN y / o GTIN plus de todo el dispositivo médico configurable. Los componentes obligatorios son aquellos que se requieren para entregar la funcionalidad del dispositivo. Los cambios o la eliminación de un componente obligatorio, que afecte la forma, el ajuste o la función del dispositivo, requieren un cambio de GTIN.
■ Los cambios en los componentes opcionales que afectan la forma, el ajuste o la función del dispositivo requieren un cambio de GTIN. Del mismo modo, la eliminación de componentes opcionales del conjunto de componentes disponibles requiere un cambio de GTIN.
Exempción:
![]() Nota 1: La adición de nuevos componentes (que no alteran la forma, el ajuste o la función que afectan el uso previsto) a una lista de selección obligatoria de componentes no requiere un cambio de GTIN.
Nota 1: La adición de nuevos componentes (que no alteran la forma, el ajuste o la función que afectan el uso previsto) a una lista de selección obligatoria de componentes no requiere un cambio de GTIN.
![]() Nota 2: El reemplazo de un componente opcional con un componente funcionalmente equivalente no requiere un nuevo GTIN.
Nota 2: El reemplazo de un componente opcional con un componente funcionalmente equivalente no requiere un nuevo GTIN.
![]() Nota 3: La adición de nuevos componentes opcionales que no afecten la forma, el ajuste o la función a los disponibles para el dispositivo médico configurable no requiere un cambio de GTIN.
Nota 3: La adición de nuevos componentes opcionales que no afecten la forma, el ajuste o la función a los disponibles para el dispositivo médico configurable no requiere un cambio de GTIN.
Ejemplos de escenarios comerciales que requieren un cambio GTIN:
Los componentes, y cómo están diseñados para interactuar entre sí, establecen los requisitos de identificación para el dispositivo completo. Un dispositivo médico configurable se identifica por su GTIN y los atributos de datos variables aplicables (por ejemplo, lote o lote, número de serie, fecha de vencimiento, fecha de producción, etc.), lo que permite que las configuraciones del dispositivo médico varíen según las combinaciones de componentes, mientras se mantiene el mismo GTIN excepto como se indica a continuación.
Figura 2‑12 Ejemplo de un dispositivo médico configurable

*GUI = interfaz gráfica de usuario (Graphical User Interface)
■ En el caso de que estos productos estén preparados específicamente para un paciente, las reglas normales de asignación de GTIN pueden no ser aplicables. Para estos dispositivos especializados, el dispositivo debe identificarse y marcarse de manera única.
■ Los dispositivos médicos configurables también pueden incluir componentes opcionales, que pueden incluirse en una configuración del dispositivo médico. Los componentes opcionales proporcionan características o extensiones a las funciones.
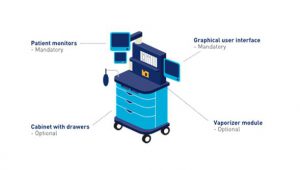
El siguiente ejemplo de dispositivo médico configurable incluye los siguientes componentes para ilustrar los componentes obligatorios y opcionales.
■ Interfaz gráfica de usuario (GUI): componente obligatorio
■ Monitores de pacientes: componente obligatorio
■ Armario con cajones – componente opcional
■ Módulo de vaporizador: componente opcional
Figura 2-13 Ejemplo de un dispositivo médico configurable
Información Adicional:
Cuando se realizan cambios en un dispositivo médico configurable, el propietario del dispositivo podría asignar un Identificador de Activo Individual Global (GIAI) (este podría ser el fabricante de los dispositivos arrendados o consignados o el usuario final de los dispositivos propios) y la gestión de los cambios en el el dispositivo se manejaría a través de un registro de cambio o mantenimiento asociado con la unidad específica identificada por un GIAI. Para obtener más información sobre la clave GIAI, consulte la sección Activos de las Especificaciones generales de GS1.
2.2.2 Software como dispositivo médico
El software para dispositivos médicos es un sistema de software desarrollado con el propósito de incorporarse a un dispositivo médico o está destinado a usarse como un dispositivo médico. El software dentro del alcance de estas reglas es un artículo comercial y tiene un precio, pedido o factura.
El software del dispositivo médico puede estructurarse de manera similar a los dispositivos médicos configurables, incluidas las funciones obligatorias y opcionales, que son similares a los componentes del dispositivo, consulte la sección 2.2.2.
Un cambio importante en la funcionalidad del software del dispositivo médico que afecta, forma, ajuste o función y uso previsto, requiere un cambio GTIN.
Niveles de jerarquía de asignación de GTIN:
■ Se asigna un GTIN al software del dispositivo médico que se puede pedir, facturar o enviar. Los diferentes niveles de licencia (por ejemplo, un número limitado de usuarios frente a las licencias empresariales) requieren la asignación de un GTIN diferente.
![]() Nota: Ejemplos de cambios importantes incluyen algoritmos nuevos o modificados, estructuras de bases de datos, arquitectura, nuevas interfaces de usuario o nuevos canales para la interoperabilidad.
Nota: Ejemplos de cambios importantes incluyen algoritmos nuevos o modificados, estructuras de bases de datos, arquitectura, nuevas interfaces de usuario o nuevos canales para la interoperabilidad.
![]() Nota: se producen cambios en el software durante la vida útil del dispositivo. Para el software de dispositivos médicos, los cambios menores no requerirán un nuevo GTIN. Ejemplos de cambios menores incluyen correcciones de errores, estética, mejoras de usabilidad, parches de seguridad o eficiencia operativa. El identificador de la aplicación (8012) para la versión de software se puede usar cuando sea necesario para administrar versiones de software. El control de versiones de software es el proceso de asignar números de versión únicos a estados únicos de software de computadora. El uso del identificador de la aplicación (8012) para la versión del software se producirá en combinación con el GTIN. Para obtener más información sobre el control de versiones del software, consulte las Especificaciones generales de GS1, sección titulada Versión del software: AI (8012).
Nota: se producen cambios en el software durante la vida útil del dispositivo. Para el software de dispositivos médicos, los cambios menores no requerirán un nuevo GTIN. Ejemplos de cambios menores incluyen correcciones de errores, estética, mejoras de usabilidad, parches de seguridad o eficiencia operativa. El identificador de la aplicación (8012) para la versión de software se puede usar cuando sea necesario para administrar versiones de software. El control de versiones de software es el proceso de asignar números de versión únicos a estados únicos de software de computadora. El uso del identificador de la aplicación (8012) para la versión del software se producirá en combinación con el GTIN. Para obtener más información sobre el control de versiones del software, consulte las Especificaciones generales de GS1, sección titulada Versión del software: AI (8012).
Ejemplo de escenario empresarial que requiere un cambio GTIN:
■ Una vez instalado, el software del dispositivo médico DEBE identificarse con su GTIN asignado cuando se separa de su embalaje o documentación física.
Ejemplo de escenario empresarial que no requiere cambio de GTIN:
■ El ejemplo en la sección 2.2.2 incluye software de dispositivos médicos que opera el dispositivo. Este software se puede configurar en función de las funciones de software seleccionadas y los componentes del dispositivo. Por ejemplo, si se selecciona un monitor de paciente adicional como componente opcional, el software debe configurarse para habilitar este componente (monitor de paciente). En tales casos, el GTIN asignado al software no requiere un cambio de GTIN.
Información Adicional:
El software del dispositivo médico que se distribuye utilizando un medio físico DEBE identificarse con el mismo GTIN en el medio físico que el asignado al software. El software del dispositivo médico que se distribuye virtualmente, como a través de una descarga, DEBERÁ tener el GTIN y cualquier identificador de aplicación relevante que se muestre dentro del software, como en la pantalla “Acerca de”.
2.3. Contenido neto declarado
El “contenido neto” se define como la cantidad del producto consumible del artículo comercial contenido en un paquete, como se declara en la etiqueta, que puede incluir peso neto, volumen, conteo, unidades.
Cualquier cambio (aumento o disminución) al contenido neto declarado legalmente requerido que se imprime en el paquete, requiere un cambio GTIN.
Niveles de jerarquía de asignación de GTIN:
■ El nivel en el que se produce el cambio en el contenido neto requiere un nuevo GTIN y todos los niveles superiores de la jerarquía afectada tendrán un nuevo GTIN.
■ Si el recuento en el nivel de la unidad base, o el nivel por debajo de “cada” cambia, se asignará un nuevo GTIN.
Ejemplos de escenarios comerciales que requieren un cambio GTIN:
Figura 2-14 Cambio en el contenido neto declarado – nuevo GTIN

![]() Nota: Los sistemas de información deben distinguir entre elementos de atención médica antiguos y nuevos cuando hay un cambio declarado en el contenido neto. Si no se distingue entre lo antiguo y lo nuevo, podría producirse un error médico y / o un precio unitario inexacto.
Nota: Los sistemas de información deben distinguir entre elementos de atención médica antiguos y nuevos cuando hay un cambio declarado en el contenido neto. Si no se distingue entre lo antiguo y lo nuevo, podría producirse un error médico y / o un precio unitario inexacto.
Información Adicional:
El contenido neto declarado es lo que se utiliza para desarrollar el etiquetado de estantes y el precio por unidad declarada al consumidor. El contenido neto declarado también es importante en entornos clínicos como la farmacia. La precisión de los datos y la capacidad de distinguir entre productos sobre la base del contenido neto es esencial y el incumplimiento puede resultar en una penalización o riesgo para los pacientes / consumidores.
Principios rectores relevantes:
|
Nombre de regla GTIN |
¿Se espera que un proveedor de atención, consumidor y / o socio comercial distinga el nuevo producto de los productos anteriores / actuales? |
¿Existe un requisito de divulgación de responsabilidad / regulación para el consumidor y / o socio comercial? |
¿Hay un impacto sustancial en la cadena de suministro (por ejemplo, cómo se envía, almacena, recibe o maneja el producto en el entorno clínico)? |
|
Contenido neto declarado |
SI |
SI |
SI |
2.4. Cambio de peso dimensional o bruto
Un cambio de más del 20% a una dimensión física, en cualquier eje (por ejemplo, altura, ancho, profundidad) o peso bruto, requiere la asignación de un nuevo GTIN.
![]() Nota: Los cambios por debajo del 20% pueden requerir un nuevo GTIN a discreción del propietario de la marca.
Nota: Los cambios por debajo del 20% pueden requerir un nuevo GTIN a discreción del propietario de la marca.
Niveles de jerarquía de asignación de GTIN:
■ La asignación GTIN se produce a nivel de artículo comercial o unidad base.
■ Se asigna un GTIN único en cada nivel existente de la jerarquía de empaquetado por encima del nivel de unidad comercial / artículo comercial.
Ejemplos de escenarios comerciales que requieren un cambio GTIN:
■ El peso bruto de un producto aumenta en un 50% de 0.34 kg (0.75 lb) a 0.51 kg (1.125 lb) debido a un cambio en el material de empaque.
■ Se puede cambiar la orientación de una caja o paleta (no hay cambios en el recuento de artículos comerciales) de manera que uno o más cambios de eje.
■ Para reducir la variedad de formatos de cajas plegables, una caja plegable con las dimensiones de 47 x 18 x 127 mm se cambia a 62 x 20 x 115 mm.
Figura 2-15 Dimensión o cambio de peso bruto
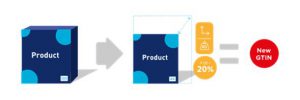
![]() Nota: El cambio del 20% se aplica a cada eje individual y no a cubo / volumen.
Nota: El cambio del 20% se aplica a cada eje individual y no a cubo / volumen.
Información Adicional:
■ Esta parte de la norma solo se aplica a los cambios en las dimensiones y el peso bruto de un producto. Cualquier cambio en el contenido neto declarado se rige por la regla sobre contenido neto declarado en la sección 2.3.
■ Los cambios acumulativos para evitar el umbral del 20%, sin cambiar el GTIN, es una práctica inaceptable. Los socios comerciales deben ser notificados sobre todos los cambios dimensionales. Los cambios acumulativos pueden causar problemas a los socios comerciales y pueden obstruir el flujo de productos.
■ Consulte el Estándar de reglas de medición del paquete GS1 para conocer un proceso consistente y repetible para determinar las mediciones de un producto determinado.
Principios rectores relevantes:
|
Nombre de regla GTIN |
¿Se espera que un proveedor de atención, consumidor y / o socio comercial distinga el nuevo producto de los productos anteriores / actuales? |
¿Existe un requisito de divulgación de responsabilidad / regulación para el consumidor y / o socio comercial? |
¿Hay un impacto sustancial en la cadena de suministro (por ejemplo, cómo se envía, almacena, recibe o maneja el producto en el entorno clínico)? |
|
Cambio de peso dimensional o bruto |
SI |
NO |
SI |
2.5. Agregar o eliminar una certificación
Dentro del sector sanitario hay muchos ejemplos de marcas de certificación. Una marca de certificación es un símbolo, logotipo o texto en un producto que declara conformidad con un conjunto de criterios regulados (por ejemplo, Marca de certificación europea CE). Cuando se cambia un producto para incluir una marca de certificación (que no se mostró previamente en el empaque o producto en sí), se debe asignar un nuevo GTIN a los mercados donde la marca de certificación es relevante. Es un principio clave de la asignación de GTIN que el GTIN identifica de forma exclusiva el producto y su configuración de empaque.
Un cambio en el embalaje para agregar una nueva o eliminar una marca de certificación existente (por ejemplo, la Marca de certificación europea CE), que tiene importancia para los organismos reguladores, los socios comerciales o el consumidor final, requiere la asignación de un nuevo GTIN.
Niveles de jerarquía de asignación de GTIN:
■ El cambio de GTIN ocurre en el nivel de la unidad base.
■ Se asigna un GTIN único en cada nivel existente de la jerarquía de empaquetado por encima del nivel de la unidad base.
Ejemplos de escenarios comerciales que requieren un cambio GTIN:
Las marcas de certificación que aparecen, o cambian, en las etiquetas de los productos que afectan los canales de distribución global debido a la licencia o registro del país, deben comunicarse entre los socios comerciales y, por lo tanto, requieren un cambio de GTIN.
Figura 2-16 Inclusión de una marca de certificación: nuevo GTIN
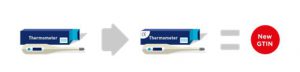
Sin embargo, también debe tenerse en cuenta que cuando se agrega una marca de certificación para permitir las ventas en un nuevo país / mercado, no tiene impacto en los países / mercados donde se vendió el producto anteriormente; en este caso, no es necesario asignar un nuevo GTIN en el escenario de arriba.
Información Adicional:
Los propietarios de marcas son responsables del control interno de su inventario y de cualquier sistema de devolución. Es importante que dichos sistemas, así como la gestión logística de entrada y salida, puedan distinguir entre el producto “antiguo” y el “nuevo”. Cuando esto se puede lograr de manera efectiva, por ejemplo, utilizando el número de lote o la variante del producto, no es necesario asignar un nuevo GTIN en este escenario, si la cadena de suministro externa no se ve afectada.
![]() Nota: Tenga en cuenta los requisitos del mercado objetivo, normativos y del cliente si esta es una práctica implementada.
Nota: Tenga en cuenta los requisitos del mercado objetivo, normativos y del cliente si esta es una práctica implementada.
Principios rectores relevantes:
|
Nombre de regla GTIN |
¿Se espera que un proveedor de atención, consumidor y / o socio comercial distinga el nuevo producto de los productos anteriores / actuales? |
¿Existe un requisito de divulgación de responsabilidad / regulación para el consumidor y / o socio comercial? |
¿Hay un impacto sustancial en la cadena de suministro (por ejemplo, cómo se envía, almacena, recibe o maneja el producto en el entorno clínico)? |
|
Agregar o eliminar una certificación |
SI |
SI |
SI |
2.6. Marca Primaria
La marca principal es la marca más reconocible por el proveedor de atención médica o el paciente, según lo determine el propietario de la marca, y puede expresarse como un logotipo y / o palabras, marca de registro o marca registrada.
Un cambio en la marca principal que aparece en el artículo comercial requiere la asignación de un nuevo GTIN.
Niveles de jerarquía de asignación de GTIN:
■ El cambio de GTIN ocurre en el artículo comercial, el nivel de la unidad base o el nivel por debajo de cada uno, si corresponde.
■ Se asigna un GTIN único en cada nivel existente de la jerarquía de empaquetado por encima del nivel de unidad comercial / artículo comercial.
Ejemplos de escenarios comerciales que requieren un cambio GTIN:
La marca principal de la compañía cambió de “Compañía de productos para el cuidado de la salud” a “Productos médicos de vanguardia para el cuidado de la salud”.
Información Adicional:
Marca compartida: el acto de aplicar una segunda marca (la “marca compartida”) por una compañía bajo un acuerdo contractual con el propietario original de la marca.
■ La empresa propietaria de la marca compartida es responsable de la asignación de GTIN.
■ La marca compartida que se aplique se construirá como la marca destacada en el paquete, tal como la ve el cliente, asegurando así la relación del producto con la marca compartida, reconocida como la “Marca principal” del producto de marca compartida.
![]() Nota: Las relaciones contractuales pueden dictar que la “Marca principal” no sea la de la marca compartida, por lo tanto, la primera marca original permanecerá destacada en el paquete. En este caso, la responsabilidad de la asignación de GTIN recae en el propietario original de la marca.
Nota: Las relaciones contractuales pueden dictar que la “Marca principal” no sea la de la marca compartida, por lo tanto, la primera marca original permanecerá destacada en el paquete. En este caso, la responsabilidad de la asignación de GTIN recae en el propietario original de la marca.
Distribuido por: Productos para los cuales existe un acuerdo entre el Propietario de la Marca y la parte identificada en la etiqueta como Distribuidor. El propietario de la marca sigue siendo responsable de la asignación de GTIN y, por lo tanto, no se necesita un nuevo GTIN cuando la identificación de Distribuido por parte se agrega a la etiqueta.
![]() Nota: La identificación de la parte “Distribuida por” no debe incluir ninguna marca de registro o marca comercial y debe hacerse solo en texto sin formato.
Nota: La identificación de la parte “Distribuida por” no debe incluir ninguna marca de registro o marca comercial y debe hacerse solo en texto sin formato.
Etiqueta de marca propia: productos en los que existe un acuerdo entre el fabricante original y la parte identificada en la etiqueta como el propietario de la marca. El propietario de la marca asume la responsabilidad de la asignación de GTIN y, por lo tanto, conserva la alineación de la marca con la asignación de GTIN.
Principios rectores relevantes:
|
Nombre de regla GTIN |
¿Se espera que un proveedor de atención, consumidor y / o socio comercial distinga el nuevo producto de los productos anteriores / actuales? |
¿Existe un requisito de divulgación de responsabilidad / regulación para el consumidor y / o socio comercial? |
¿Hay un impacto sustancial en la cadena de suministro (por ejemplo, cómo se envía, almacena, recibe o maneja el producto en el entorno clínico)? |
|
Marca Primaria |
SI |
SI |
NO |
2.7. Producto de tiempo crítico o promocional
Las promociones son normalmente modificaciones a corto plazo en la forma en que se presenta el artículo.
Un cambio a un producto que se está promocionando (incluidos los cambios de empaque) para un evento o fecha específicos, que afecta el manejo requerido en la cadena de suministro para garantizar que el artículo comercial esté disponible para la venta durante un período de tiempo específico, requiere la asignación de un nuevo GTIN .
Niveles de jerarquía de asignación de GTIN:
■ No se requiere un cambio de GTIN en el nivel de la unidad base.
■ Los niveles existentes de la jerarquía de empaquetamiento por encima de la unidad base requieren que se asigne un GTIN único para promociones de tiempo crítico.
Ejemplos de escenarios comerciales en los que se requiere un GTIN único en un nivel superior de embalaje (por ejemplo, paquete, caja, paleta):
■ Un artículo de prueba gratuito (no identificado con su propio GTIN) se adjunta a un artículo existente durante un período promocional, el contenido neto declarado del artículo original no cambia y las dimensiones del empaque y el peso bruto del producto NO se modifican en más de 20%
Ejemplos de escenarios comerciales que no requieren un cambio GTIN:
■ Promoción: compre 2, obtenga 1 gratis.
■ Los gráficos en las vendas giran trimestralmente. Los gráficos no tienen relevancia estacional o de tiempo crítico y se consideran productos de flujo continuo.
![]() Nota: Cualquier promoción que afecte el contenido del producto, o que requiera una nueva presentación reglamentaria, se considera un cambio importante y se debe asignar un nuevo GTIN.
Nota: Cualquier promoción que afecte el contenido del producto, o que requiera una nueva presentación reglamentaria, se considera un cambio importante y se debe asignar un nuevo GTIN.
Información Adicional:
■ Para productos de tiempo crítico o promocionales, el GTIN para el artículo comercial / nivel de unidad base no necesita ser cambiado, pero para el seguimiento en la cadena de suministro, los niveles más altos de empaque deben ser identificados de manera única.
■ Las regulaciones locales, nacionales o regionales pueden requerir cambios GTIN más frecuentes. Dichas regulaciones tienen prioridad sobre las reglas provistas dentro de las Reglas de asignación de GTIN de atención médica.
Principios rectores relevantes:
|
Nombre de regla GTIN |
¿Se espera que un proveedor de atención, consumidor y / o socio comercial distinga el nuevo producto de los productos anteriores / actuales? |
¿Existe un requisito de divulgación de responsabilidad / regulación para el consumidor y / o socio comercial? |
¿Hay un impacto sustancial en la cadena de suministro (por ejemplo, cómo se envía, almacena, recibe o maneja el producto en el entorno clínico)? |
|
Producto de tiempo crítico o promocional |
SI |
NO |
SI |
2.8. Cantidad por paquete / caja
Esta regla aborda las agrupaciones de artículos comerciales predefinidas con contenido predefinido. Un cambio en el número predefinido de artículos comerciales contenidos en un paquete o caja (es decir, la agrupación de artículos comerciales) requiere la asignación de un nuevo GTIN al nivel cambiado y todos los niveles afectados anteriores. Un cambio en la cantidad de cajas en una configuración de paleta predefinida requiere la asignación de un nuevo GTIN.
Niveles de jerarquía de asignación de GTIN:
■ Se asigna un GTIN único en cada nivel existente de la jerarquía, incluido y por encima del nivel más bajo que se modifica.
Ejemplos de escenarios comerciales en los que se requiere un GTIN único en el empaque de nivel superior (por ejemplo, paquete, caja, paleta):
■ La configuración de un caso cambia de contener 8 artículos comerciales a contener 12 artículos comerciales, el caso necesita ser identificado de manera única.
■ La configuración de una paleta cambia de contener 12 cajas a contener 16 cajas, la paleta necesita ser identificada de manera única.
Información Adicional:
Consulte la sección 2.1.2 para la asignación de GTIN a cada uno, nivel por debajo de cada unidad individual y niveles más altos de empaque.
Principios rectores relevantes:
|
Nombre de regla GTIN |
¿Se espera que un proveedor de atención, consumidor y / o socio comercial distinga el nuevo producto de los productos anteriores / actuales? |
¿Existe un requisito de divulgación de responsabilidad / regulación para el consumidor y / o socio comercial? |
¿Hay un impacto sustancial en la cadena de suministro (por ejemplo, cómo se envía, almacena, recibe o maneja el producto en el entorno clínico)? |
|
Cantidad por paquete / caja |
NO |
SI |
SI |
2.8.1 Cantidad por paquete / caja
Esta regla se aplica cuando el pallet es un artículo comercial y debe identificarse para fines de pedido y facturación con un GTIN. En este caso, se aplican las reglas de asignación de GTIN, incluidas las de jerarquía de empaquetado.
Un cambio en la cantidad de cajas en una configuración de paleta predefinida requiere la asignación de un nuevo GTIN. El diseño de la paleta no afecta la asignación de GTIN de artículos comerciales empaquetados en los casos en la paleta. Por lo tanto, un cambio de un GTIN para una paleta no requiere un cambio de GTIN a los niveles más bajos de empaque.
Niveles de jerarquía de asignación de GTIN:
■ Se asigna un GTIN único a cada configuración de paleta que contiene diferentes cantidades de casos cuando la paleta es un artículo que se puede pedir.
Ejemplos de escenarios comerciales que requieren un cambio GTIN:
Figura 2-17 Las configuraciones de paletas predefinidas adicionales o nuevas para realizar pedidos requieren un GTIN diferente

Información Adicional:
■ Las paletas requieren un GTIN solo cuando son un artículo comercial (es decir, con precio, pedido o facturado).
■ Cuando un palet es una unidad de logística (por ejemplo, envío, transporte, almacenamiento) se identifica con un Código de contenedor de envío en serie (SSCC).
■ Consulte las Especificaciones generales de GS1 para obtener más información sobre el etiquetado logístico y los SSCC.
2.9. Cantidad por paquete / caja
Un surtido predefinido se define como un paquete de dos o más artículos comerciales diferentes que se combinan y venden juntos como un solo artículo comercial.
Un cambio, adición o reemplazo de uno o más artículos comerciales incluidos en un surtido predefinido requiere la asignación de un nuevo GTIN.
Principios rectores relevantes:
|
Nombre de regla GTIN |
¿Se espera que un proveedor de atención, consumidor y / o socio comercial distinga el nuevo producto de los productos anteriores / actuales? |
¿Existe un requisito de divulgación de responsabilidad / regulación para el consumidor y / o socio comercial? |
¿Hay un impacto sustancial en la cadena de suministro (por ejemplo, cómo se envía, almacena, recibe o maneja el producto en el entorno clínico)? |
|
Surtido predefinido |
SI |
SI |
SI |
2.9.1 Kits
Los kits son colecciones de componentes no homogéneos y separables que se identifican, compran y suministran como un único artículo comercial para un propósito clínico o comercial específico.
Hay dos tipos principales de kits:
■ Kit de productos terminados: kits que son un conjunto de solo productos terminados. Los componentes son artículos comerciales, donde cada componente es un artículo comercial identificado por un GTIN. Los componentes no necesitan ser empacados individualmente; pero se identifican de forma independiente en el nivel de empaque del componente, independientemente del kit (por ejemplo, puede ser vendible, identificado y disponible para el comercio).
■ Kit fabricado: kits que se completan o terminan en el proceso de kitting. Al menos un componente de un kit fabricado no es un artículo comercial terminado y, por lo tanto, no se identifica con un GTIN.
Niveles de jerarquía de asignación de GTIN:
El creador del kit o kitter es responsable de asignar el GTIN al kit.
■ El cambio de GTIN se produce en el kit y en todos los niveles anteriores.
Se aplican las siguientes reglas de cambio de GTIN:
■ Agregar un componente del kit requiere un nuevo GTIN. Ver Figura 2 18.
■ La eliminación de un componente del kit requiere un nuevo GTIN. Ver Figura 2 19.
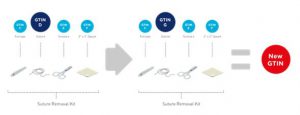
■ Cuando los componentes del kit se identifican por GTIN y / o el número de artículo del propietario de la marca, y ese componente del kit se sustituye, se cambiará el GTIN del kit. Ver Figura 2 20.
■ Cuando los componentes del kit se enumeran solo por descripción (es decir, sin GTIN o número de artículo del propietario de la marca), el fabricante del kit puede sustituir ese componente del kit (manteniendo la forma, el ajuste y la función) sin tener que cambiar el GTIN del kit. Ver Figura 2 21.
Ejemplos de escenarios comerciales que requieren un cambio GTIN:
Figura 2-18 Adición de un componente a un kit

Figura 2‑19 Retirada de un componente de un kit
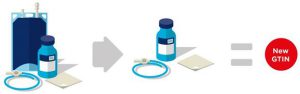
Figura 2‑20 Kit con componentes específicos
Ejemplos de escenarios comerciales que no requieren un cambio GTIN:
Figura 2-21 Kit con componentes no específicos
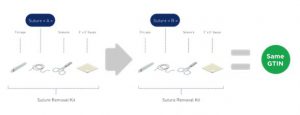
2.10. Precio en el empaque
El precio en el paquete se define como cuando el propietario de la marca incluye precios previos como parte de los gráficos del paquete. Esta regla no se aplica a los precios marcados en un boleto de precio, pegatina, etiqueta colgante o cualquier cosa que pueda eliminarse del paquete o producto.
Cualquier adición, cambio o eliminación de un precio marcado directamente en el paquete del producto (no recomendado) requiere la asignación de un nuevo GTIN.
Niveles de jerarquía de asignación de GTIN:
■ El cambio de GTIN ocurre en el nivel de la unidad base.
■ Se asigna un GTIN único en cada nivel existente de la jerarquía de empaquetado por encima del nivel de la unidad base.
Ejemplo de escenarios comerciales que requieren un cambio de GTIN:
■ El precio preimpreso en un paquete cambia de Q 3 a Q 2.
■ Se agrega un precio de venta de Q 8 al gráfico de empaque del producto.
Información Adicional:
Se desaconseja el pre-precio como práctica comercial, ya que introduce complejidad para el mantenimiento del archivo de artículos comerciales a través de la cadena de suministro. Además, existe el peligro de que la declaración de precios al consumidor (en el paquete) sea diferente al precio cobrado (precio en el (los) minorista (s) o sistema de salud). Sin embargo, el pre-precio puede ser un requisito obligatorio de las autoridades reguladoras.
Principios rectores relevantes:
|
Nombre de regla GTIN |
¿Se espera que un proveedor de atención, consumidor y / o socio comercial distinga el nuevo producto de los productos anteriores / actuales? |
¿Existe un requisito de divulgación de responsabilidad / regulación para el consumidor y / o socio comercial? |
¿Hay un impacto sustancial en la cadena de suministro (por ejemplo, cómo se envía, almacena, recibe o maneja el producto en el entorno clínico)? |
|
Precio en el empaque |
SI |
SI |
SI |
3. Ensayos clínicos
Se lleva a cabo un ensayo clínico para investigar la eficacia y la seguridad de los tratamientos, las intervenciones o las pruebas, para prevenir, controlar o detectar enfermedades u otras afecciones médicas. Los ensayos clínicos pueden comparar un nuevo tratamiento con el existente, probar diferentes combinaciones de tratamientos existentes o incluso observar otros factores del estilo de vida y su impacto en el bienestar del paciente.
Los ensayos clínicos tienen complejidades de identificación de productos que no se ven hoy en la cadena de suministro de atención médica comercial. La singularidad de un producto en investigación, que en muchos casos es solo para un paciente, significa que es necesario identificarlo en la instancia del producto. En los ensayos cegados, las partes cegadas no deberían poder ver en el etiquetado si el producto en investigación es un artículo de prueba, un comparador o un placebo. La aplicación de los estándares GS1 para ensayos clínicos debe tener en cuenta estas complejidades y las necesidades de la industria.
En el caso de que cambie la presentación del producto, consulte el estándar de aplicación de Ensayos clínicos.
■ Para obtener información específica sobre las Reglas de asignación de GTIN, consulte la sección 7 del Estándar de aplicación de identificación de productos en investigación en ensayos clínicos.
■ Para obtener información general, consulte el Estándar de aplicación de identificación de productos en investigación en ensayos clínicos.
4. Información adicional sobre GTIN
Número de artículo comercial global
Los números globales de artículos comerciales (GTIN) pueden ser utilizados por una empresa para identificar de forma única todos sus artículos comerciales. GS1 define artículos comerciales como cualquier artículo (producto o servicio) sobre el cual existe la necesidad de recuperar información predefinida y que puede ser tasada, ordenada o facturada en cualquier punto de cualquier cadena de suministro. Para obtener más información sobre GTIN, consulte las Especificaciones generales de GS1.
Estructura de un GTIN
Las compañías pueden obtener una licencia de un Prefijo de Compañía GS1 de una Organización Miembro GS1 que viene con documentación completa sobre cómo asignar GTIN a sus productos.
Los GTIN deben tratarse como números no significativos. Esto significa que siempre deben registrarse y procesarse en su totalidad; ninguna parte del número se relaciona con ninguna clasificación ni transmite ninguna información.
Prefijo de compañía GS1
Los Prefijos de Compañía GS1 están autorizados por las Organizaciones Miembros GS1 a una compañía usuaria para autorizar a esa compañía usuaria a crear cualquiera de las claves de identificación GS1, como GTIN, SSCC o GIAI.
![]() Note: While the GS1 Company Prefix can be used to determine which GS1 Member organisation allocated the prefix, it cannot be used to determine where an item was produced or distributed.
Note: While the GS1 Company Prefix can be used to determine which GS1 Member organisation allocated the prefix, it cannot be used to determine where an item was produced or distributed.
U.P.C. Company Prefix
A U.P.C. Company Prefix is derived from a GS1 Company Prefix that starts with zero (‘0’) by removing that leading zero. A U.P.C. Company Prefix SHALL only be used to construct 12-digit trade item identifiers (e.g. GTIN-12). When a leading zero is added to a U.P.C. Company Prefix it becomes a GS1 Company Prefix that may be used to issue all other GS1 identification keys.
![]() Nota: Por ejemplo, el U.P.C. de 6 dígitos. El Prefijo de Compañía 614141 se deriva del Prefijo de Compañía GS1 de 7 dígitos 0614141.
Nota: Por ejemplo, el U.P.C. de 6 dígitos. El Prefijo de Compañía 614141 se deriva del Prefijo de Compañía GS1 de 7 dígitos 0614141.
Referencia del artículo
La referencia del artículo es un componente del Número de artículo comercial global (GTIN) asignado por la organización a la que se le asignó el Prefijo de compañía GS1 o U.P.C. El Prefijo de Compañía ha sido licenciado para crear un GTIN único y es un número no significativo, lo que significa que los dígitos individuales en el número no se relacionan con ninguna clasificación ni transmiten información específica. La forma más simple de asignar las referencias de elementos es secuencialmente, es decir, 000, 001, 002, 003, etc.
Comprobar dígito
El dígito de verificación es el último dígito. Se calcula a partir de todos los demás dígitos en el GTIN.
La figura a continuación muestra las cuatro estructuras GTIN y cómo deben almacenarse en una base de datos. Los GTIN deben estar justificados a la derecha y cero a la izquierda.

![]() Nota 1: cuando cualquiera de estos GTIN está codificado en un soporte de datos que debe codificar una cadena de datos de longitud fija de 14 dígitos, los GTIN cuando tienen menos de 14 dígitos de longitud deben tener el prefijo de ceros rellenos que simplemente actúan como dígitos de relleno . Agregar ceros de relleno no cambia un GTIN-8, 12 o 13 en un GTIN-14. Sin embargo, los ceros de “relleno” no están codificados en los códigos de barras EAN-8, U.P.C-A o EAN-13
Nota 1: cuando cualquiera de estos GTIN está codificado en un soporte de datos que debe codificar una cadena de datos de longitud fija de 14 dígitos, los GTIN cuando tienen menos de 14 dígitos de longitud deben tener el prefijo de ceros rellenos que simplemente actúan como dígitos de relleno . Agregar ceros de relleno no cambia un GTIN-8, 12 o 13 en un GTIN-14. Sin embargo, los ceros de “relleno” no están codificados en los códigos de barras EAN-8, U.P.C-A o EAN-13
![]() Nota 2: el formato GTIN de 14 dígitos se usa en transacciones comerciales, especialmente para comercio electrónico (por ejemplo, pedidos electrónicos, facturas, catálogos de precios, etc.) y en la Red de sincronización de datos global (GDSN).
Nota 2: el formato GTIN de 14 dígitos se usa en transacciones comerciales, especialmente para comercio electrónico (por ejemplo, pedidos electrónicos, facturas, catálogos de precios, etc.) y en la Red de sincronización de datos global (GDSN).
Indicador
El indicador solo se usa en la estructura de datos GTIN-14. Toma el valor de 1 a 8 (ver la Nota 1 a continuación) y se usa para niveles de embalaje más bajos o más altos. La forma más sencilla de asignar el indicador es secuencialmente, es decir, 1, 2, 3 … a cada grupo de artículos comerciales.
Una agrupación uniforme de artículos comerciales es una agrupación ordenable de artículos comerciales idénticos. El propietario de la marca tiene la opción de asignar un GTIN-13 o GTIN-12 único a cada grupo o asignar un GTIN-14 único con un valor de dígito indicador de 1 a 8. Estos GTIN-14 incorporan el GTIN del artículo comercial ( menos su dígito de verificación) contenido en cada grupo. El dígito de verificación para cada GTIN-14 se vuelve a calcular. Debido a las opciones de valor de 1 a 8, se pueden crear ocho GTIN-14 únicos y separados a partir de un solo GTIN-13 o GTIN-12.
Los dígitos del indicador no tienen significado. Los dígitos no tienen que usarse en orden secuencial y algunos pueden no usarse en absoluto. La estructura GTIN-14 para agrupaciones de artículos comerciales estándar crea una capacidad de numeración adicional. El dígito indicador asignado según lo requerido por la compañía que construye el GTIN.
![]() Nota 1: El valor del indicador 9 está reservado para elementos de medida variable. Medida variable: si la medida de los artículos contenidos en un caso, no está predefinida, entonces el artículo comercial es de medida variable. Algunos de los atributos relacionados con este artículo comercial de medida variable, como el recuento de unidades contenidas y el peso, por ejemplo, no están predefinidos, pero solo se conocerán cuando se fabrique el producto. Debe decidirse por adelantado si un elemento es una medida fija con atributos esenciales predefinidos o una medida variable, donde una medida, como el recuento de unidades contenidas, no está predefinida, sino que es específica de cada instancia. En tales casos, se puede utilizar un GTIN-14 con Indicador 9 e Identificador de Aplicación (30). Para obtener más información, consulte la sección Recuento variable de elementos: AI (30) de las Especificaciones generales de GS1. Se encuentra información adicional sobre la medida variable en las siguientes secciones de la Especificación general GS1: Artículos comerciales de medida variable escaneados en distribución general y artículos comerciales de medida variable escaneados en el punto de venta minorista.
Nota 1: El valor del indicador 9 está reservado para elementos de medida variable. Medida variable: si la medida de los artículos contenidos en un caso, no está predefinida, entonces el artículo comercial es de medida variable. Algunos de los atributos relacionados con este artículo comercial de medida variable, como el recuento de unidades contenidas y el peso, por ejemplo, no están predefinidos, pero solo se conocerán cuando se fabrique el producto. Debe decidirse por adelantado si un elemento es una medida fija con atributos esenciales predefinidos o una medida variable, donde una medida, como el recuento de unidades contenidas, no está predefinida, sino que es específica de cada instancia. En tales casos, se puede utilizar un GTIN-14 con Indicador 9 e Identificador de Aplicación (30). Para obtener más información, consulte la sección Recuento variable de elementos: AI (30) de las Especificaciones generales de GS1. Se encuentra información adicional sobre la medida variable en las siguientes secciones de la Especificación general GS1: Artículos comerciales de medida variable escaneados en distribución general y artículos comerciales de medida variable escaneados en el punto de venta minorista.
![]() Nota 2: Algunos escáneres en el punto de venta minorista pueden no ser capaces de leer e interpretar simbologías de códigos de barras que no sean EAN / UPC, que no pueden codificar un GTIN-14.
Nota 2: Algunos escáneres en el punto de venta minorista pueden no ser capaces de leer e interpretar simbologías de códigos de barras que no sean EAN / UPC, que no pueden codificar un GTIN-14.
![]() Nota 3: Consulte las secciones de GTIN de Especificaciones Generales GS1 para obtener más información.
Nota 3: Consulte las secciones de GTIN de Especificaciones Generales GS1 para obtener más información.
![]() Nota 4: Para obtener más información sobre cómo construir un GTIN, consulte Cómo crear un GTIN en el sitio web de GS1 o póngase en contacto con su Organización Miembro GS1 local.
Nota 4: Para obtener más información sobre cómo construir un GTIN, consulte Cómo crear un GTIN en el sitio web de GS1 o póngase en contacto con su Organización Miembro GS1 local.
5. Glosario de términos
Para obtener la última definición de términos, consulte www.gs1.org/glossary.
|
Termino |
Definición |
|
Identificador de la aplicación (AI) |
El campo de dos o más caracteres al comienzo de una Cadena de elementos GS1 que define de forma exclusiva su formato y significado. |
|
Ensayo |
Un ensayo es un procedimiento de investigación (analítico) en medicina de laboratorio, farmacología, biología ambiental y biología molecular para evaluar cualitativamente o medir cuantitativamente la presencia, cantidad o actividad funcional de una entidad objetivo (el analito) |
|
paquete de barrera |
Un tipo de paquete que protege el contenido del contacto con sustancias externas u otras influencias externas. Dependiendo del material y del proceso de embalaje, puede proporcionar protección contra, p. luz, humedad o microorganismos, es decir, preservar la esterilidad de los contenidos. |
|
paquete de medicamentos |
Un tipo de paquete en el que el material (frecuentemente plástico o lámina de metal) se forma en una o más ampollas, cada una de las cuales generalmente contiene una unidad del producto. Las bases abiertas de las células de la ampolla generalmente se sellan mediante la fijación de una capa de papel de aluminio o plástico o papel que se perforará cuando se accede a una célula, lo que hace que la manipulación sea obvia (evidencia de manipulación). |
|
dueño de la marca |
La organización que posee las especificaciones de un artículo comercial, independientemente de dónde y quién lo fabrique. El propietario de la marca normalmente es responsable de la gestión del Número de artículo comercial global (GTIN). |
|
embalaje / bolsa de ventilación |
Un paquete de capa de material fibroso. Paquete de respiradero para elementos quirúrgicos tales como suturas o conjuntos de aguja de sutura que tienen una capa de material fibroso y una capa de material plástico que forma un bolsillo entre ellas. |
|
dígito de verificación |
Un dígito final calculado a partir de los otros dígitos de algunas claves de identificación GS1. Este dígito se utiliza para verificar que los datos se hayan compuesto correctamente. |
|
caplet |
Una tableta recubierta para medicación oral. |
|
Marca compartida |
El acto de aplicar una marca reconocible adicional (marca secundaria), logotipo, marca comercial o marca de registro a la etiqueta o paquete del producto, donde coexiste con la marca principal. Esto normalmente se llevaría a cabo bajo un acuerdo contractual con el propietario original de la marca. |
|
marcado directo de piezas |
El marcado directo de partes se refiere al proceso de marcar un símbolo en un artículo utilizando un método intrusivo o no intrusivo. |
|
Dosis |
La cantidad por aplicación y la frecuencia de aplicación de un medicamento. |
|
cada / unidad base |
En una jerarquía de empaque de artículos comerciales, la Unidad base o Cada uno denota el nivel de artículos comerciales de consumo minorista. El término se refiere al nivel de empaquetado comercializado más bajo. Este nivel puede contener más de una sola unidad / unidad de uso. |
|
Código de producto electrónico (EPC) |
Un esquema de identificación para identificar universalmente objetos físicos (por ejemplo, artículos comerciales, activos y ubicaciones) a través de etiquetas RFID y otros medios. Los datos EPC estandarizados consisten en un EPC (o identificador EPC) que identifica de forma exclusiva un objeto individual, así como un valor de filtro opcional cuando se considera necesario para permitir una lectura efectiva y eficiente de las etiquetas EPC. |
|
cadena de elementos |
La combinación de un identificador de aplicación GS1 y un campo de datos de identificador de aplicación GS1. |
|
equivalente |
Un producto que puede ser sustituido por el artículo comercial basado en la equivalencia funcional definida por el proveedor para el artículo comercial. |
|
formulación |
Definición de la combinación de diferentes sustancias químicas, incluidos los ingredientes activos, que constituyen un medicamento final. |
|
Forma, ajuste o función. |
Un cambio en las especificaciones o el diseño del producto que cambia el propósito / uso previsto y debe comunicarse al cliente. |
|
Prefijo de compañía GS1 (GCP) |
Una cadena única de cuatro a doce dígitos utilizada para emitir claves de identificación GS1. Los primeros dígitos son un Prefijo GS1 válido y la longitud debe ser al menos uno más larga que la longitud del Prefijo GS1. El Prefijo de Compañía GS1 es emitido por una Organización Miembro GS1. Como el Prefijo de Compañía GS1 varía en longitud, la emisión de un Prefijo de Compañía GS1 excluye que todas las cadenas más largas que comienzan con los mismos dígitos se emitan como Prefijos de Compañía GS1. Ver también el Prefijo de Compañía U.P.C. |
|
Especificaciones generales de GS1 |
Define los datos del sistema GS1 y los estándares de aplicación relacionados con el marcado y la identificación automática de artículos comerciales, ubicaciones, unidades logísticas, activos y más utilizando códigos de barras, RFID y claves de identificación GS1. |
|
Oficina Global GS1 |
Con sede en Bruselas, Bélgica, y Princeton, EE. UU., Es una organización de Organizaciones Miembros GS1 que administra el sistema GS1. |
|
Organización Miembro GS1 (GS1 MO) |
Un miembro de GS1 que es responsable de administrar el sistema GS1 en su país (o área asignada). Esta tarea incluye, entre otras, garantizar que las empresas usuarias hagan un uso correcto del sistema GS1, tengan acceso a educación, capacitación, promoción y soporte de implementación y tengan acceso para desempeñar un papel activo en GSMP. |
|
Sistema GS1 |
Las especificaciones, estándares y pautas administrados por GS1. |
|
Número de artículo comercial global® (GTIN®) |
La clave de identificación GS1 utilizada para identificar artículos comerciales. La clave comprende un Prefijo de Compañía GS1, una referencia de artículo y un dígito de verificación. |
|
Red global de sincronización de datos (GDSN) |
La GS1 Global Data Synchronization Network® (GDSN®) es una red de grupos de datos interoperables que permite a los usuarios colaboradores sincronizar de forma segura los datos maestros basados en los estándares GS1. |
|
Interfaz gráfica de usuario (GUI) |
Interfaz gráfica de usuario: es una forma de interfaz de usuario que permite a los usuarios interactuar con dispositivos electrónicos a través de iconos gráficos e indicadores de audio, como la notación primaria, en lugar de interfaces de usuario basadas en texto, etiquetas de comandos escritos o navegación de texto. |
|
indicador |
Un dígito del 1 al 9 en la posición más a la izquierda del GTIN-14. |
|
referencia del artículo |
Un componente del Número de artículo comercial global (GTIN) asignado por el propietario de la marca para crear un GTIN único. |
|
HRI |
La interpretación legible por humanos (HRI) es la información a continuación, al lado o por encima de un código de barras o etiqueta que está codificada en el código de barras o etiqueta y representa los mismos caracteres que el código de barras o etiqueta. Consulte las Especificaciones Generales GS1, sección Reglas de interpretación legible por humanos (HRI) para obtener más información. |
|
equipo |
Una colección de diferentes artículos sanitarios regulados reunidos para su uso en una sola terapia. |
|
Kitter |
El propietario de la marca que define el contenido del kit, las especificaciones y el etiquetado. El kitter puede o no ensamblar kits y puede contratar a un tercero para que produzca los artículos comerciales terminados.. |
|
Nivel debajo de cada |
El nivel jerárquico más bajo de artículos comerciales dentro del Sistema GS1 se conoce tradicionalmente como el nivel “cada”. El artículo comercial de “cada” nivel puede contener más de una unidad de uso. En este caso, puede ser necesario identificar niveles por debajo de “cada uno” hasta la única unidad o unidad de uso. En la industria de la salud, puede haber una unidad “más pequeña” o “más baja”, que se escaneará en el “Punto de atención de la salud, comúnmente conocido como el” Nivel debajo de cada uno “ dispositivo médico Cualquier instrumento, aparato, implemento, máquina, aparato, implante, reactivo o calibrador in vitro, software, material u otro artículo similar o relacionado, destinado por el fabricante para ser utilizado, solo o en combinación, para seres humanos para cualquier médico propósito. |
|
dispositivo médico |
Cualquier instrumento, aparato, implemento, máquina, aparato, implante, reactivo o calibrador in vitro, software, material u otro artículo similar o relacionado, destinado por el fabricante para ser utilizado, solo o en combinación, para seres humanos para cualquier propósito médico. |
|
No HRI |
El texto no HRI es todo otro texto en el paquete, etiqueta o artículo. Consulte las Especificaciones Generales GS1, sección Reglas de interpretación legible por humanos (HRI) para obtener más información. |
|
Producto farmacéutico |
Un producto farmacéutico es cualquier tipo de medicamento utilizado con fines medicinales, como jarabe para la tos o pastillas para dormir. |
|
Marca principal |
La marca principal es la marca más reconocible por el proveedor de atención o el paciente, según lo determine el propietario de la marca, y puede expresarse como un logotipo, marca de registro o marca comercial. |
|
paquete primario |
Un artículo comercial regulado de atención médica son productos farmacéuticos o dispositivos médicos que se venden o dispensan en un entorno controlado (por ejemplo, farmacia minorista, farmacia hospitalaria). |
|
Artículo comercial regulado de atención médica |
Un artículo comercial regulado de atención médica son productos farmacéuticos o dispositivos médicos que se venden o dispensan en un entorno controlado (por ejemplo, farmacia minorista, farmacia hospitalaria). |
|
Rx (producto de prescripción médica) |
Un medicamento o especialidad medicinal que requiere una receta médica o intervención médica directa. Los ejemplos típicos incluyen vendajes medicados, medicamentos para el dolor, inyectables, etc. y normalmente solo se pueden obtener con una receta de un profesional de la salud adecuado. |
|
ello interno a externo (SITO) |
Un tipo de paquete de barrera que consta de dos capas. En un proceso de producción especial, la capa interna (con frecuencia una bolsa de aluminio) inicialmente permanece abierta para la esterilización del contenido y luego se sella a través de la capa externa, que se cerró antes y permanece intacta en todo momento. |
|
paquete secundario |
La capa de embalaje que rodea el paquete primario. Se puede usar con fines de presentación y marca o para protección mecánica adicional que el paquete primario podría no ser capaz de proporcionar. Puede contener uno o más paquetes primarios. |
|
paquete de unidad individual / blister |
Un paquete primario de atención médica que contiene una forma de dosificación farmacéutica discreta, es decir, una tableta, un cierto volumen de líquido o que es el paquete inmediato para un dispositivo médico como una jeringa. Se pueden unir varias unidades individuales entre sí, pero son fáciles de separar a través de una perforación. |
|
fuerza |
Cantidad de ingrediente (s) activo (s) en un medicamento. |
|
artículo comercial: |
Any item (product or service) upon which there is a need to retrieve predefined information and that may be priced, or ordered, or invoiced at any point in any supply chain |
|
U.P.C. Prefijo de compañía |
Un Prefijo de Compañía GS1 que comienza con un cero (‘0’) se convierte en U.P.C. Prefijo de empresa eliminando el cero inicial. Una U.P.C. El Prefijo de Compañía se usa para emitir GTIN-12. |
Si llegará a tener alguna duda o comentario con gusto nuestro departamento de servicio al afiliado le podrá atender por vía correo electrónico servicio.afiliado@gs1gt.org o vía telefónica (2245-9595)








